BAB VII
BENZENA DAN TURUNANNYA
A. Struktur Benzena
Benzena merupakan hidrokarbon aromatik yang paling sederhana dengan rumus molekul C6H6. Benzena terdiri atas satu cincin enam karbon dengan satu atom hidrogen terikat pada setiap karbon dan terdapat tiga buah ikatan rangkap karbon dengan karbon. Struktur benzena dapat dinyatakan dengan dua cara yaitu struktur kekule dan struktur delokalisasi π .
1. Struktur Kekule
Struktur benzena pertama kali dikemukakan pada tahun 1865 oleh Kekule. Kekule mengemukakan bahwa 6 atom karbon yang terdapat di sudut-sudut heksagon beraturan, dengan satu atom hidrogen melekat pada setiap atom karbon. Menurut Kekule, agar setiap atom karbon mempunyai valensi empat (4) maka harus terdapat ikatan tunggal dan ganda yang berseling di sekeliling cincin. Struktur benzena dengan rumus kekule dapat dituliskan seperti berikut.
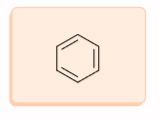
2. Struktur Delokalisasi π
Oleh karena elektron-elektron pada ikatan rangkap dalam senyawa benzena tersebar di seluruh cincin maka struktur benzena adalah sangat stabil. Para ahli kimia, kemudian menggambarkan struktur benzena dengan merujuk pada sistem elektron π (pi) delokalisasi. Benzena digambarkan sebagai segi enam beraturan dengan lingkaran di dalamnya. Perhatikan struktur benzena berikut.
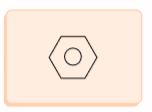
B. Tata Nama Benzena
Untuk memudahkan penamaan senyawa benzena, maka senyawa ini dibagi menjadi tiga kelas yaitu seperti berikut.
1. Benzena Monosubstitusi
Benzena monosubstitusi merupakan benzena di mana satu atom H disubstitusi dengan substituen. Tata nama benzena monosubstitusi menurut sistem IUPAC adalah seperti berikut.
Nama subtituen + benzena
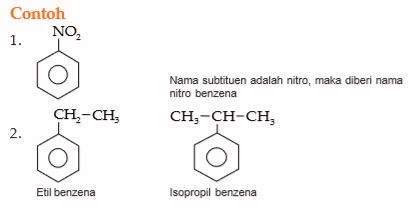
Sejumlah benzena monosubstitusi mempunyai nama trivial. Perhatikan tata nama menurut IUPAC dan nama trivial dari senyawa benzena monosubstitusi berikut.
Tabel 7.1 Nama IUPAC dan Trivial Benzena
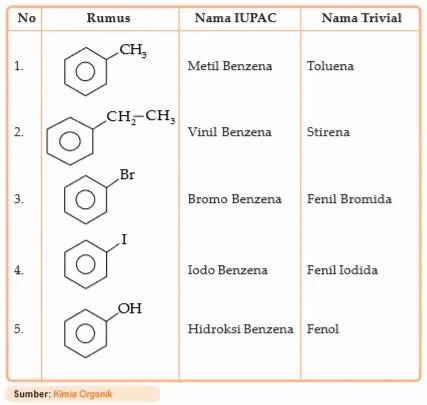
2. Benzena Disubstitusi
Pada benzena ini terdapat dua substituen, sehingga untuk struktur isomer digunakan awalan orto (o), meta (m), dan para (p). Jika substituen berada pada posisi 1 dan 2 maka diberi awalan orto atau o. Adapun jika substituen berada pada posisi 1 dan 3 maka diberi awalan meta atau m. Dan jika substituen berada pada posisi 1 dan 4 maka diberi awalan para atau p.
Contoh:
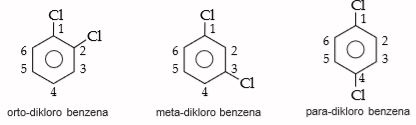
Substituen-substituen pada contoh di atas adalah sama. Bagaimana jika subtituennya berbeda? Jika dua substituennya berbeda, maka salah satu dianggap sebagai senyawa utama dan gugus yang lain dianggap sebagai gugus terikat dengan urutan prioritas seperti berikut. –COOH, –SO3, –CH3, –CN, –OH, –NH2, –R, –NO2, –X.
Contoh
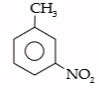
Oleh karena gugus CH3 lebih relatif dari NO2 maka CH3 sebagai gugus terikat dan NO2 sebagai gugus lain. Jadi, senyawa tersebut dinamakan meta-nitro toluena.
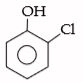
Oleh karena gugus OH lebih relatif dari Cl maka senyawa tersebut diberi nama orto-kloro fenol.
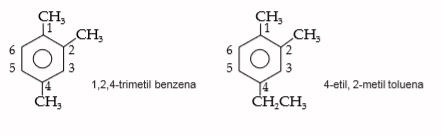
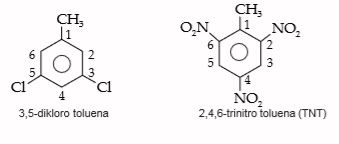
3. Benzena Substitusi Lebih dari Dua
Benzena dengan substituen lebih dari dua maka penamaannya dijelaskan seperti berikut.
- Digunakan sistem penomoran
- Substituen diurutkan secara alfabet
Contoh:
C. Sifat-Sifat Senyawa Benzena
Bagaimana sifat-sifat senyawa benzena? Benzena mempunyai sifat fisika dan kimia seperti berikut.
1. Sifat Fisika Benzena
Benzena memiliki titik didih dan titik leleh yang khas. Perhatikan data titik didih dan titik leleh senyawa benzena berikut.
Tabel 7.2 Titik Didih dan Titik Leleh Senyawa Benzena
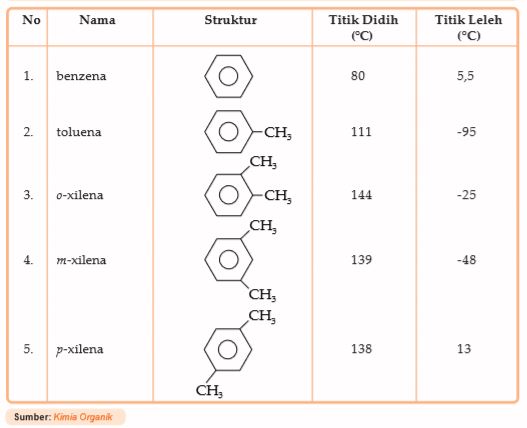
Dari tabel di atas dapat dilihat bahwa p-xilena mempunyai titik leleh yang lebih tinggi daripada o-xilena atau m-xilena. Titik leleh yang tinggi merupakan sifat khas benzena substitusi karena pada bentuk p isomer lebih simetris dan dapat membentuk kisi kristal yang lebih teratur dan lebih kuat daripada bentuk orto atau meta.
2. Sifat Kimia
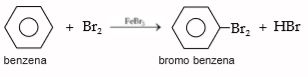
Benzena tidak dapat mengalami reaksi adisi, tetapi mengalami reaksi substitusi. Reaksi substitusi yang terjadi adalah seperti berikut. a. Halogenasi Halogenasi ini dicirikan oleh brominasi benzena dengan katalis FeBr3. Peranan katalis ini adalah membelah ikatan Br – Br. Perhatikan reaksi halogenasi pada benzena berikut.
1. Halogenasi
Halogenasi ini dicirikan oleh brominasi benzena dengan katalis FeBr3. Peranan katalis ini adalah membelah ikatan Br – Br. Perhatikan reaksi halogenasi pada benzena berikut.
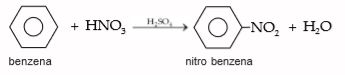
2. Nitrasi
Reaksi nitrasi terjadi jika benzena diolah dengan HNO3 dengan katalis H2SO4. Reaksi yang terjadi adalah seperti berikut.
 3. Alkilasi
3. Alkilasi
Alkilasi sering disebut juga dengan Friedel – Crafts. Reaksi ini menggunakan katalis AlCl3. Reaksi ini dikembangkan oleh ahli kimia Perancis Charles Friedel dan James Crafts. Perhatikan reaksi alkilasi 2 kloro propana dengan benzena dengan katalis AlCl3 (reaksi Friedel – Crafts).
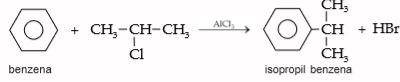
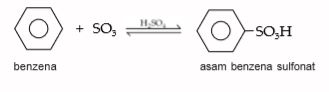
4. Sulfunasi
Reaksi sulfunasi suatu benzena dengan asam sulfat berasap menghasilkan asam benzena sulfonat. Perhatikan reaksi sulfunasi berikut.
D. Senyawa Turunan Benzena dan Kegunaannya
Senyawa turunan benzena banyak manfaatnya, di antara seperti berikut.
1. Nitro Benzena (C6H5NO2)
Nitro benzena adalah zat cair yang berwarna kuning muda dan beracun. Nitro benzena digunakan untuk memberi bau pada sabun dan semir sepatu.
2. Anilin (C6H4NH2)
Anilin adalah zat cair berupa minyak, tidak berwarna, dan digunakan sebagai bahan untuk membuat zat warna. Anilin juga digunakan untuk membuat obat-obatan dan plastik.
3. Toluena (C6H5CH3)
Toluena (C6H5CH3) sebagai bahan dasar pembuatan zat warna.
4. Asam Benzoat (C6H5COOH)
Asam benzoat dapat dibuat menjadi asam salisilat C6H4(OH)(COOH), sakarin, aspirin, dan natrium benzoat. Natrium benzoat digunakan sebagai pengawet pada bahan makanan, misal selai dan roti.
5. Fenol (C6H5OH)
Fenol (C6H5OH) disebut juga hidroksi benzena. Fenol adalah zat padat putih, hablur mudah larut dalam air, larutannya bersifat asam, tidak bersifat alkohol. Larutan 3% fenol dalam air digunakan sebagai pemusnah hama (air karbon).
Fenol yang dipanaskan dengan formaldehida dan suatu basa, menghasilkan suatu jenis plastik. Fenol direaksikan dengan asam nitrat pekat menghasilkan asam pekat C6H5OH(NO2)3 yang digunakan sebagai bahan dasar untuk pembuatan peledak.
6. Benzil Alkohol (C6H5CH2OH)
Benzil alkohol (C6H5CH2OH) disebut juga fenil metanol. Benzil alkohol digunakan sebagai pelarut.
7. Benzaldehid
Benzaldehid (C6H5COH) atau fenil metanol dibuat dengan mengoksidasi benzil alkohol. Benzaldehid adalah zat cair seperti minyak, tidak berwarna, dan berbau istimewa, digunakan dalam wangi-wangian. Benzaldehid juga digunakan pada industri zat warna dan aroma.
Referensi:
Sukmanawati, Wening. 2009. Kimia 3: Untuk SMA dan MA Kelas XII. Jakarta: Pusat Perbukuan, Departemen Pendidikan Nasional.
